티스토리 뷰
축전지
일반적으로 화학 에너지를 전기에너지로 변환시키는 방전과 또 다른 전원으로부터 전기에너지를 공급하여 화학 에너지로 변화시켜 축적하는 충전을 반복하는 전지를 축전지 또는 이차 전지라고 말합니다. 일반적으로 많이 사용하고 있는 건전지와 같은 일차 전지는 충전과 방전이 반복되지 않습니다. 보통의 건전지는 충전해서 사용하지 않는 것처럼 말입니다. 축전지에는 납 축전지와 알칼리 축전지가 있습니다. 축전지는 1개당 기본 전압이 2V이며, 방전됨에 따라서 전압이 강하하여 어느 값에 도달하면, 갑자기 감소하여 0이 됩니다. 이때의 어느 특정 값은 방전 정지 전압(Final Discharge Voltage)이라고 하며, 이 이하로 사용되지 않습니다.
납 축전지
납 축전지는 과산화납(PbO2)을 사용한 양극과 음극에 해면상의 납을 사용한 음극을 비중이 1.2~1.3인 황산에 넣은 것입니다. 실제로는 극판의 면적 증가를 위하여 많은 양극과 음극의 극판이 병렬로 연결되어 있으며, 각각의 극판 사이에는 절연물로 만든 격리 판이 들어 있습니다. 충전된 상태에서는 양극은 이산화납, 음극은 납이지만 방전을 계속하면 양극과 음극은 모두 황산납으로 변하며, 동시에 물이 생기게 되므로 전해액의 비중이 저하됩니다. 또 충전된 상태에서 양극은 다갈색, 음극은 납 색으로, 방전을 계속하면 양극이 다 같이 회백색으로 바뀌게 됩니다. 납 축전기의 기전력은 약 2V이지만, 방전하는 사이에 천천히 저하하여서 1.8V 정도까지 저하하면 다시 충전시켜야 합니다.
축전지는 크기에 상관없이 기전력은 다 같지만, 극관 면적을 증가하여 전지의 조를 크게 하면 용량이 증가하여 더 많은 전류를 흐르게 할 수 있습니다. 충전은 전지의 양 단자에 전원의 양 단자를 연결하고 규정의 전륫값을 유지하면서 계속됩니다. 충전이 진행됨에 따라서 양극판은 다갈색으로, 음극판은 납 색으로 변화하며 충전 전류를 흘리는 상태에서 전압이 2.7~2.8V로 높아집니다. 전해액의 비중이 서서히 증가하여 1.26 정도로 되면 충전 종료로 보아도 됩니다. 충전과 방전의 반복 횟수가 많은 것은 1,000회 이상이 되며, 사용할 수 있는 기간이 긴 것은 몇 년 됩니다. 축전지의 효율은 충전과 방전할 때의 암페어시 또는 와트시의 비로 나타내며 암페어시 효율, 와트시 효율이라고 합니다. 전자는 대개 90%, 후자는 일반적으로 75% 정도 됩니다. 축전지의 기전력은 주위의 온도가 변화해도 거의 변화하지 않는다고 볼 수 있습니다. 하지만 약 -30℃의 저온에서는 성능이 저하합니다.
알칼리 축전지
양극에 수산화니켈, 음극에 카드뮴, 전해액으로는 알칼리 용액을 사용한 것을 융 너(Jungner)식 알칼리 축전기라고 합니다. 융 너식 축전지에서 음극을 카드뮴 대신 철을 사용한 것을 에디슨식 알칼리 축전지라고 합니다. 일반적으로 융 너식 알칼리 축전지가 널리 사용되고 있습니다. 기전력은 약 1.2V이며, 방전 종료 시에는 1.1V로 됩니다. 암페어시 효율은 약 85% 정도이고, 와트시 효율은 약 80% 정도 됩니다. 알칼리 축전지는 진동에 강하며, 자기방전이 적고 평균 수명이 길어서 7~25년 사용할 수 있습니다. 또한 -20~45℃의 넓은 온도 범위에서 사용할 수 있습니다.
알칼리 축전지 중에서 극판에 니켈과 카드뮴을 사용한 것은 극판의 제조법 중, 소결법을 사용하여 만든 것도 있습니다. 이는 내부저항이 작고 완전히 밀봉되어 만들어졌기 때문에 소형 경량화되어 저온에서의 특성이 좋습니다. 또한, 산화은 분말을 망에 도포해서 굳힌 것을 양극판으로 하고, 수산화아연을 음극판으로 하여서 전해액으로는 수산화칼륨 용액을 사용한 알칼리 축전지가 있습니다. 방전 중의 전압은 1.2~1.5, 소 중량으로 대용량이 만들어지고 급격한 대전류가 흐를 수 있는 등의 특징이 있기 떄문에, 가격은 비싸지만, 통신병기나 로켓의 전원으로 주목되고 있습니다.
축전지의 화학반응
축전지에 외부회로가 형성되어서 전기가 흘러나가면 양극판(PbO2)과 음극판(Pb)이 전해액 중의 황산과 화학 반응하여서 서서히 황산납으로 변하고 전해액은 물에 가깝게 되어갑니다. 따라서 방전을 계속하면 물질은 완전히 황산납으로 되어서 전기를 발생할 수 없게 됩니다. 이 상태를 완전 방전상태라고 합니다. 전해액의 농도는 축전지의 방전 전기량에 비례하여 변화되기 때문에 비중계로 전해액 비중을 측정함으로써 축전지의 방전상태를 알 수 있습니다.
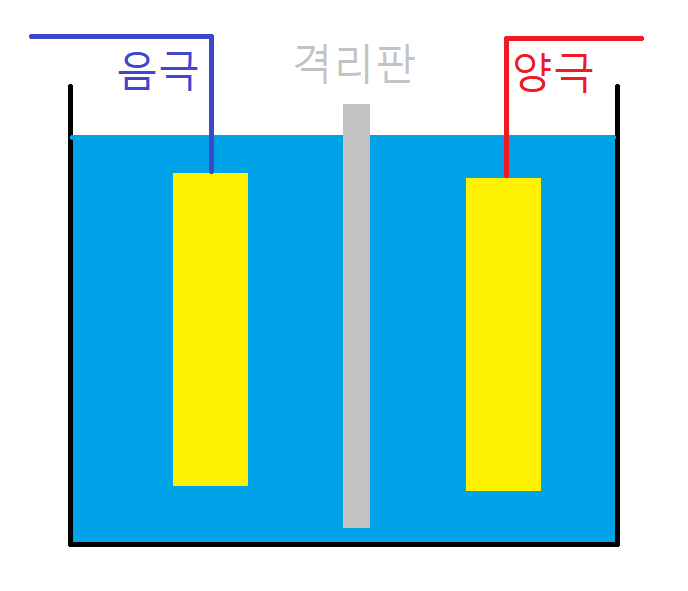
외부로부터 축전지에 전기를 넣어 주면 황산납으로 되어 있던 양극 활성물질 및 음극 활성물질은 점차 과산화납, 그리고 해면상 납으로 되돌아가며, 전해액은 묽은 황산으로 다시 돌아갑니다. 충전이 진행되어 전지가 완전충전 상태로 다시 돌아가면 물이 전기분해 되어서 양극에서 산소와 음극에서 수소가 매우 심하게 발생합니다. 격리판은ㄴ 유리섬유, 에보나이트, 플라스틱을 사용합니다. 양극판의 단락을 방지하기 위해서 양극판과 음극판 사이에 얇은 격리 판을 삽입하면, 축전기의 고장을 방지할 수 있습니다.
축전기에서 최초로 시행되는 충전을 초충전이라고 하며, 전지의 모든 상태를 좌우합니다. 충전 전류는 암페어시 전류의 20~30%이고, 시간은 70~80시간입니다. 묽은 황산의 비중은 1.840 정도로 합니다. 초충전 시 2V에서 시작되어 2.3V, 2.6~2.8V까지 올라갑니다. 이후 단자 전압 및 비중이 일정량에 달하면 초충전은 완료됩니다. 이후 평상 충전과 속 충전, 과충전, 균등 충전과 부동충전 등의 방식이 있습니다.
전원 설비와 수변전 설비의 구성과 정류기
통신용 전원 설비 송신기의 전원은 이동용을 제외하고는 일반적으로 교류전원을 정류하여서 사용합니다. 전원회로에서 중요한 것은, 안정되고 충분한 용량을 가질 것과 공급 전압의 전압 변동
outinfo.co.kr
전기의 기본, 옴의 법칙
옴의 법칙이란 옴의 법칙은 전기회로 내의 전류(I), 전압(V), 저항(R) 사이의 상호 관계를 나타내는 매우 중요한 법칙입니다. 도체의 두 점 사이에 흐르는 전류의 크기는 둔 점 사이의 전압에 비례
outinfo.co.kr
'과학' 카테고리의 다른 글
| 측정기의 주요 종류와 데시벨 (0) | 2023.07.12 |
|---|---|
| 측정과 오차, 그리고 최소제곱법 (0) | 2023.07.11 |
| 전원 설비와 수변전 설비의 구성과 정류기 (0) | 2023.07.10 |
| 송수신기의 구조와 종류 - FM 송수신기 (0) | 2023.07.10 |
| 송수신기의 구조와 종류 - AM 송수신기 (0) | 2023.07.09 |
- Total
- Today
- Yesterday
- 불리언
- GSM
- CDMA
- CDMA-2000
- 불린 값
- 전파의 성질
- 귀환회로
- 주파수 측정기
- HSDPA
- FDMA
- 차단기
- FM
- 변조
- 송수신기
- 전기
- 주파수
- 공진 주파수
- 회로 시험기
- 셀분할
- 불대수
- 기본 법칙
- 저항
- AM
- 전원설비
- v=ir
- 안테나
- 3G
- LRC회로
- 이동전호
- 전파
| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | |
| 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 |
| 28 | 29 | 30 | 31 |
